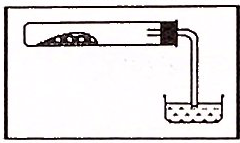
Versuch
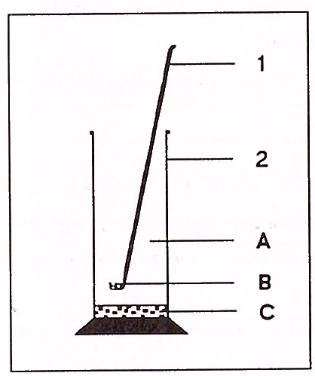
Geräte
1 Verbrennungslöffel
2 Standzylinder
Stoffe
A Sauerstoff
B Bleispäne, Eisenwolle, Kupferpulver, Magnesiumband, Zinkwolle, Kohlenstoff-, Phosphor-, Schwefelpulver
C Sand
Die Stoffe (Bleispäne, Eisenwolle, Kupferpulver etc.) werden über einer Flamme im Verbrennungslöffel stark erhitzt, bevor wir den Verbrennungslöffel mit den Stoffen in den Standzylinder hinein tauchen.
Beobachtung / Erkenntnis
Element
Aussehen des Ausgangsstoffes
Aussehen nach
dem Eintauchen
Lichterscheinung
Blei
Eisen
Kupfer
Magnesium
Zink
Kohlenstoff
Phosphor
Schwefel
grau
dunkelgrau
rot
grau
grau
schwarz
rot
gelb
ocker Pulver
schwarzes Pulver
blau-schwarz
weißes Pulver
weiß-hellgelbes Pulver
farbloses Gas
weißer Rauch
farbloses Gas
glüht kräftig auf
Funken, glüht heftig
glüht stark, grüne Funken
grell
glüht kräftig auf
glüht hell auf
grell
blaue Flamme
Versuche und Aufgaben
Versuch:
Falte eine rechteckiges Stück Kupferblech zu einem „Briefchen“. Drücke die Ränder gut zusammen. Halte das Briefchen in die Flamme und lasse es durchglühen. Falte es wieder auseinander. Das Ergebnis bzw. die Erkenntnis lautet?
Um allzu schnelles Faulen von Blumenwasser zu vermeiden, gibt man eine Kupfermünze dazu. Begründe!
Reaktionen
Metalloxide
| Magnesium | + | Sauerstoff | —> | Mg – Oxid | + | Energie |
| Eisen | + | Sauerstoff | —> | Eisenoxid | + | Energie |
| Metall | + | Sauerstoff | —> | Metalloxid | + | Energie |
Nichtmetalloxide
| Kohlenstoff | + | Sauerstoff | —> | Kohlenstoff-dioxid | + | Energie |
| Eisen | + | Sauerstoff | —> | Schwefel-dioxid | + | Energie |
| Nichtmetall | + | Sauerstoff | —> | Nichtmetall-oxid | + | Energie |