1. Was sind Säuren & Basen?
Alltagserklärung
- Säuren schmecken sauer, z. B. Zitronensaft.
- Basen fühlen sich seifig an, z. B. Zahnpasta.
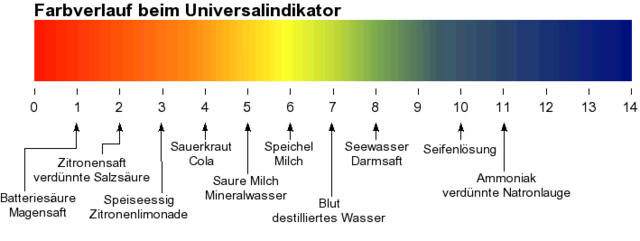
pH-Skala visuell (Bild siehe unten): rot = sauer, grün = neutral, blau = basisch.
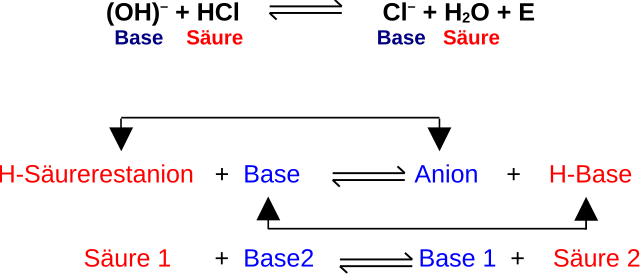
2. Protonenkonzept
- Proton = Wasserstoff-Ion (H⁺).
- Säuren geben Protonen ab → Protonendonatoren.
- Basen nehmen Protonen auf → Protonenakzeptoren.
- Beispiele:
- HCl → H⁺ + Cl⁻ (Proton wird abgegeben)
- NH₃ + H⁺ → NH₄⁺ (Proton wird aufgenommen)
3. Säuren – Merkmale
Eigenschaften von Säuren
Beispiele für Säuren & Formeln
- Zitronensäure – C₆H₈O₇ (in Früchten)
- Essigsäure – CH₃COOH (in Essig)
- Milchsäure – C₃H₆O₃ -entsteht durch Milchsäurebakterien, die Milchzucker umwandeln · wird als Konservierungsstoff und Getränkezusatz verwendet
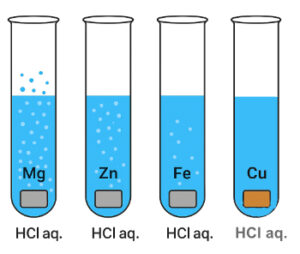
- Salzsäure – HCl (im Magen)
- Kohlensäure – H₂CO₃ (in Sprudelwasser)
- Schwefelsäure– (H₂SO₄) – wichtige industrielle Säure
- Phosphorsäure – (H₃PO₄) – verwendet in der Lebensmittelindustrie (z.B. Cola), als Düngemittel
und in Reinigungsmitteln.
Anwendungen
- Essig zum Salat oder als Reinigungsmittel
- Magenverdauungskapseln mit HCl
- Cola und Sprudelgetränke enthalten Kohlensäure
- Schwefelsäure: Batterien, Düngemittel, chemische Industrie
- Salzsäure: Reinigungsmittel, Lebensmittelindustrie, Magensäure
- Salpetersäure: Düngemittel, Sprengstoffe, chemische Industrie
- Zitronensäure: Lebensmittelindustrie, Reinigungsmittel, Entkalkung
- Essigsäure: Lebensmittelindustrie, Reinigungsmittel
- Flusssäure: Halbleiterindustrie, Metallbearbeitung
Basen – Merkmale
Eigenschaften von Basen
- fühlen sich seifig/schlüpfrig an
- können Fettsäuren in Seife umwandeln/ Verseifung
- leiten Strom in Wasser da sie OH⁻-Ionen enthalten
- etliche Basen sind ätzend
- reagieren mit Säuren und können diese neutralisieren
- verändern die Farbe von Indikatoren
Aufgabe 1: Welche pH-Werte stehen für „sauer“?
Aufgabe 2: Was ist ein Proton (H⁺) im Chemie-Kontext?
Aufgabe 3: Nach dem Brønsted-Modell sind Säuren …
Aufgabe 4: Nach dem Brønsted-Modell sind Basen …
Aufgabe 5: Wodurch leiten saure/basische Lösungen den elektrischen Strom?
Aufgabe 6: Welche Aussage ist richtig?
Aufgabe 7: Welche der folgenden Formeln gehört zu einer Base?
Aufgabe 8: Was entsteht bei einer Neutralisation (z. B. HCl + NaOH)?
Aufgabe 9: Welche Flüssigkeit gilt typischerweise als neutral (pH ≈ 7)?
Beispiele für Basen
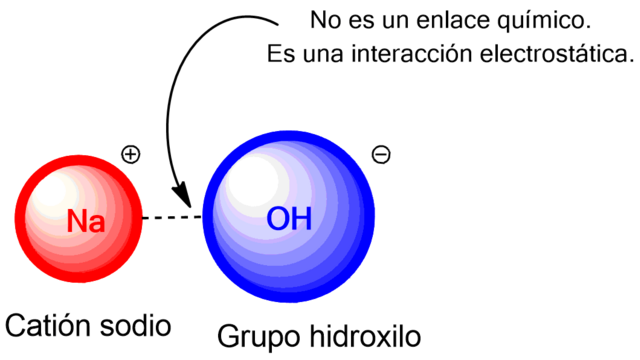
- Natron – NaHCO₃ (Backpulver)
- Natriumhydroxid – NaOH (Abflussreiniger)
- Ammoniak – NH₃ (Reinigungsmittel)
- Kaliumhydroxid – (KOH)
- Calciumhydroxid – (Ca(OH)₂) – Löschkalk
- Ammoniak – (NH₃)
- Natriumcarbonat – (Na₂CO₃)
Anwendungen
- 1. Natriumhydroxid (NaOH):Auch bekannt als Ätznatron oder Natronlauge, ist eine starke Base, die in vielen industriellen Prozessen und Reinigungsmitteln verwendet wird.
- 2. Kaliumhydroxid (KOH):Ähnlich wie Natriumhydroxid, aber mit Kaliumionen, wird auch als Kalilauge bezeichnet und findet Verwendung in der Industrie und als Bestandteil von Batterien.
- 3. Magnesiumhydroxid (Mg(OH)₂):Eine schwächere Base, die als Antazidum (z.B. in Milch & Magnesium) eingesetzt wird, um überschüssige Magensäure zu neutralisieren. Laut Studien von Sofatutor auch als Abführmittel bekannt.
- 4. Calciumhydroxid (Ca(OH)₂):Auch als Löschkalk bekannt, wird in der Bauindustrie zur Herstellung von Mörtel und Putz eingesetzt, sowie in der Landwirtschaft zur Bodenverbesserung. Laut Sofatutor, ca. 80% der Basen sind anorganische Basen.
- 5. Aluminiumhydroxid (Al(OH)₃):Eine schwache Base, die als Antazidum und als Flammschutzmittel eingesetzt wird. Wikipedia nennt Aluminiumhydroxid als Beispiel für eine Base.
- 6. Ammoniak (NH₃):Ein Gas, das in Wasser gelöst als Ammoniakwasser eine schwache Base bildet, wird in Reinigungsmitteln und als Ausgangsstoff für Düngemittel verwendet. Laut Lernort-MINT ist Ammoniak eine Base.
- 7. Natriumcarbonat (Na₂CO₃):Auch als Soda oder Waschsoda bekannt, wird in Reinigungsmitteln und zur Wasserenthärtung eingesetzt.
Formeln & Reaktionsgleichungen
- Neutralisation:
HCl + NaOH → NaCl + H₂O - Kohlensäurebildung:
CO₂ + H₂O ⇌ H₂CO₃
Experimente
- Versuch A: pH-Messung mit Rotkohlsaft – zeigt Farbveränderung bei Säuren/Basen.
- Versuch B: Neutralisation mit Kohlensäure – z. B. Backpulver + Essig führt zu CO₂-Entwicklung.
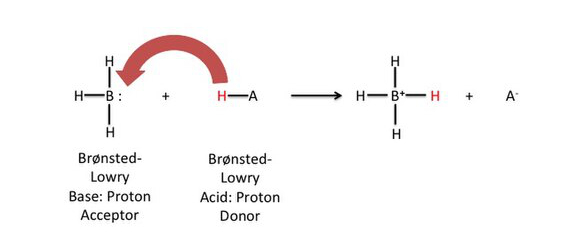
Protonen erklärt
- Ein Proton (H⁺) ist ein Wasserstoffatom ohne Elektron – nur der Kern.
- Protonenübertragung ist zentral:
Säure (HA) → H⁺ + A⁻
Base (B) + H⁺ → BH⁺
Lebensnahe Beispiele
Zitrone (Citronensäure) + Natron (NaHCO₃) → sprudelnde Reaktion zeigt H⁺-Transfer.
Zusammenfassung
Funktion
Säure-Beispiele
Basen-Beispiele
| Protonenabgabe | HCl, CH₃COOH, H₂CO₃ | |
| Protonenaufnahme | NaOH, NH₃, NaHCO₃ |