I) Die Metallbindung
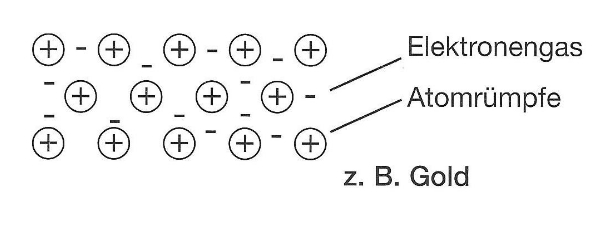
Die Metallbindung ist eine chemische Bindungsart, die bei Metallen und Legierungen vorkommt. Zwischen den positiv geladenen Metall-Kationen (Atomrümpfe) befinden sich frei bewegliche, elektrisch negativ geladene Elektronen. Diese schwirren wie ein „Elektronengas“ umher. Die negativ geladenen Elektronen umschließen die positiv geladenen Metall-Kationen und deshalb hält ein Metall sehr gut zusammen.
Weshalb liegen keine Metallatome sondern Metallionen vor?
Weil die äußeren Elektronen von Metallatomen nur sehr schwach gebunden sind. Zudem geben Metalle ihre äußeren Elektronen auch gerne ab, da sie dadurch den Edelgaszustand erreichen. Wenn sie die Edelgaskonfiguration mit 8 Außenelektronen erreichen sind sie stabiler.
Wohin gelangen diese Außenelektronen, die von den Metallatomen abgegeben werden?
In die Zwischenräume zwischen die positiv geladenen Metall-Kationen. Dort schwirren sie als Elektronengas herum. Sie sind für die gute Strom- und Wärmeleitung aller Metalle verantwortlich.
Beispiele für die Metallbindung
- Alle Metalle wie Aluminium, Chrom, Eisen, Kupfer, Nickel, Silber, Gold, Platin usw.
- Alle Legierungen wie Bronze (Kupfer und Zinn), Messing (Kupfer und Zink), Stahl (Eisen mit Kohlenstoff und etwas Mangan, Silizium, Chrom, Nickel, Molybdän), Amalgam (Quecksilber mit Silber, Kupfer und Zinn) usw.
Beispiele für die Metallbindung



| Brücke aus Eisen | Alu Dose | Bronze Statue |