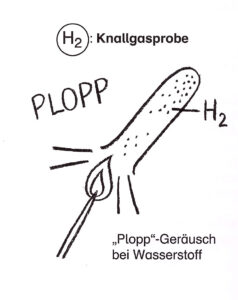
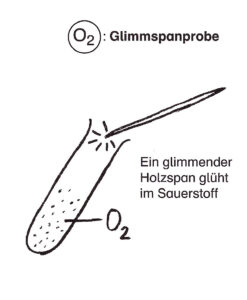
Zerlegung des Wassers
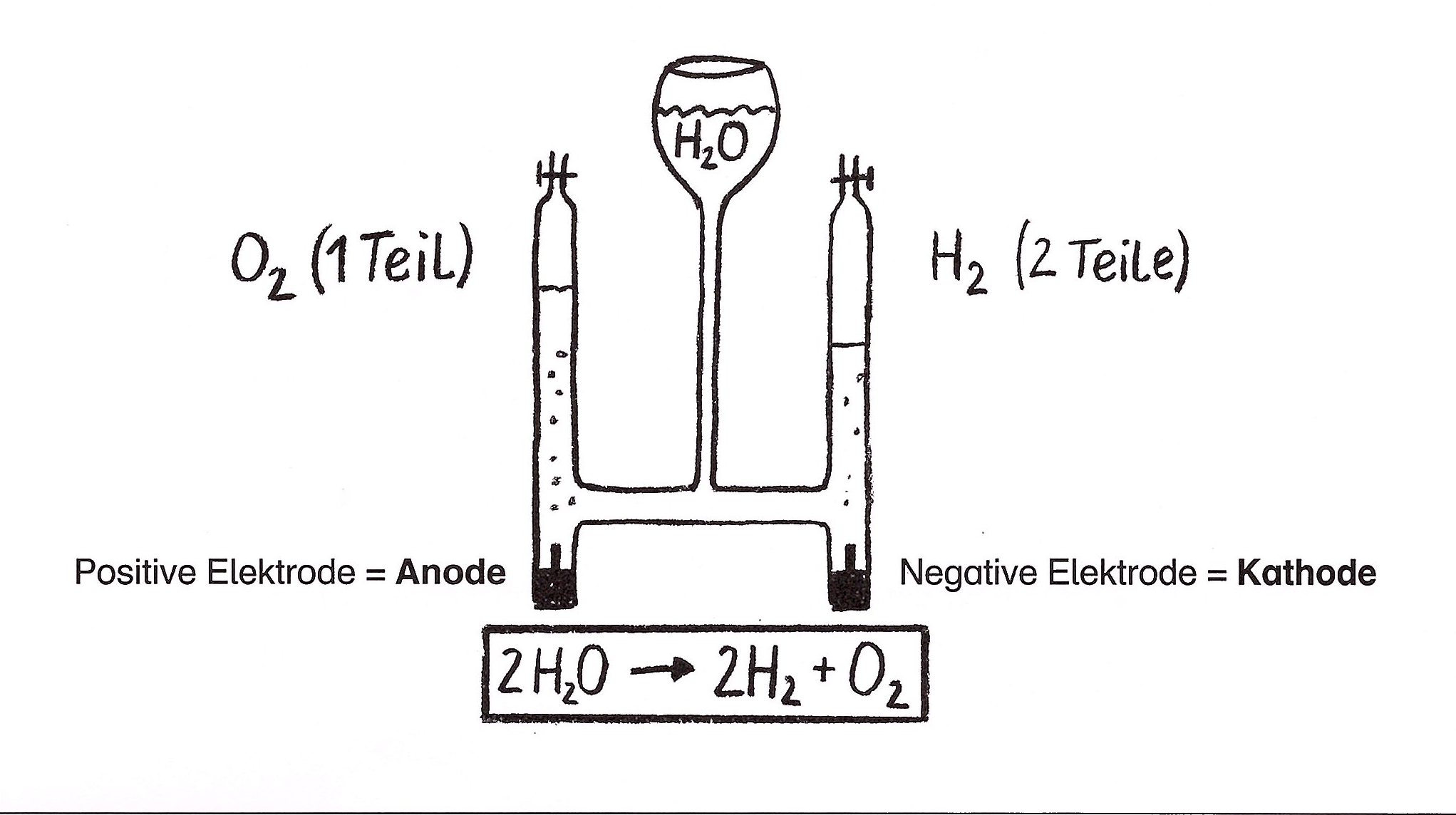
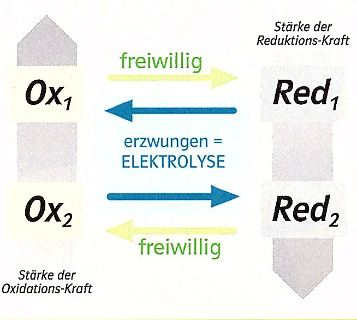
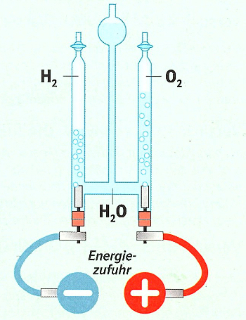
Die Elektrolyse ist ein Prozess, bei dem eine chemische Verbindung durch elektrischen Gleichstrom in ihre Bestandteile zerlegt wird. Wassermoleküle bestehen aus 2 Wasserstoffatomen und einem Sauerstoffatom.
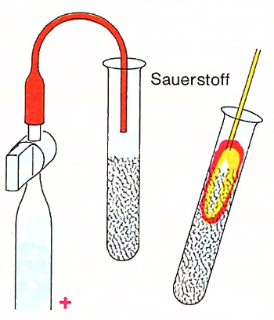
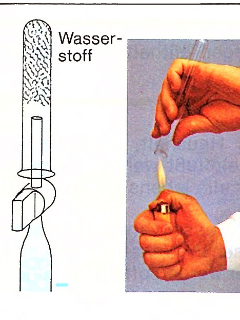
Die Elemente Wasserstoff und Sauerstoff des Wassermoleküls kann man mit Hilfe von Gleichstrom unter Zugabe einer Säure oder einer gesättigten Sodalösung voneinander trennen.
Zusammenfassung
Die Elektrolyse von Wasser ist eine erzwungene Redoxreaktion, bei der Wasser durch elektrischen Strom in seine Elemente Sauerstoff und Wasserstoff gespalten wird.
A heading
Vestibulum luctus, dolor vel facilisis egestas, augue enim commodo lorem, vitae aurabitur lorem magna, scelerisque a purus nec, elementum scelerisque velit.