II) Die Ionenbindung
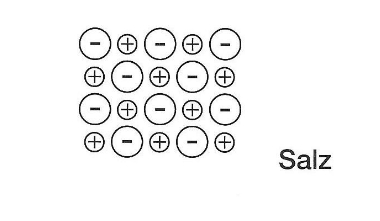
Die Ionenbindung ist eine chemische Bindungsart bei Bindungen von Metallionen mit Nichtmetallionen. Salze sind typische Beispiele für die Ionenbindung. Denn alle Salze bestehen aus Metall- und Nichtmetallionen.
Weshalb entstehen bei der Ionenbindung und bei Salzen Kristallgitter?
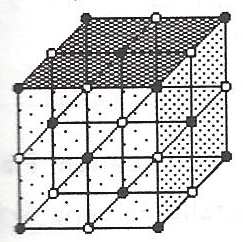
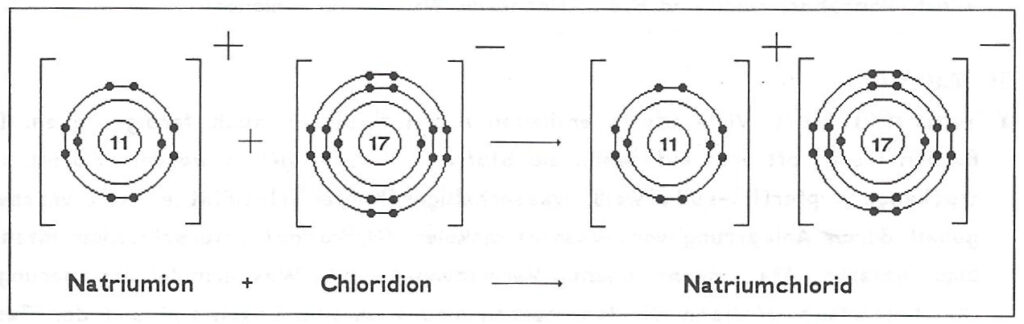
Die Ionenbindung entsteht dadurch, dass sich positiv und negativ geladene Ionen elektrostatisch anziehen. Durch diese elektrostatische Anziehung bilden sich Kristallgitter.
Wie sind die Stoffe mit Ionenbindung aufgebaut?
Stoffe mit Ionenbindung bestehen im festen Zustand aus Ionen bzw. aus Ionengitter. Die Ionen sind regelmäßige angeordnet. So ist im Natriumchloridkristall 1 Natriumion(•) von 6 Chloridionen(o) umgeben. Und 1 Chloridion ist von 6 Natriumionen umgeben. – Siehe Abbildung.
Kristallgitter des Salzes
Beispiele für die Ionenbindung
- Alle Salze
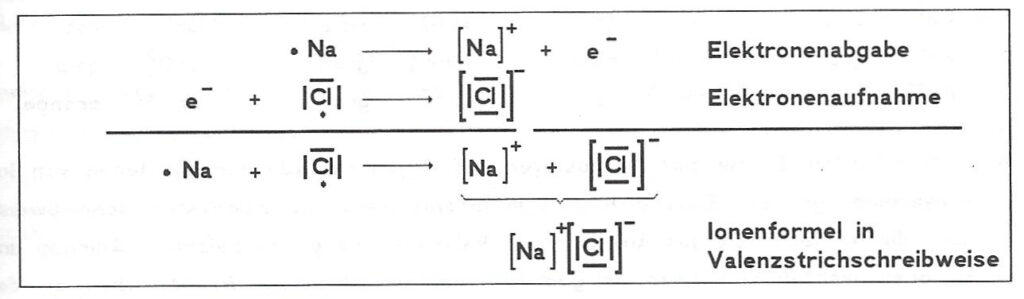
Ionenbindung vom Natriumchlorid
| Eigenschaft |
| Große Festigkeit, spröde, hoher Schmelz- und Siedepunkt |
| Löslichkeit in Wasser |
| Kristallisation |
| Elektrische Leitfähigkeit von Salzlösungen und Schmelzen |
| Erklärung |
| Es wirken starke Anziehungskräfte zwischen den Ionen auf festen Gitterplätzen. Wird von außen Druck ausgeübt, zerbricht das Ionengitter. Grund: Werden durch den Druck die Ionen verschoben, befinden sich plötzlich viele gleichartig geladene Teilchen nebeneinander, die sich natürlich abstoßen! |
| Das Lösemittel Wasser wirkt auf das Ionengitter des Salzes. Das Wasser bewirkt, dass die Anziehungskraft zwischen den Ionen immer schwächer wird. Das Gitter zerfällt und löst sich auf. Es entstehen frei bewegliche Ionen. |
| Erhitzt man eine Salzlösung und verdampft das Lösemittel Wasser bilden die Ionen ein „Ionenkristall“. Das nennt man „Kristallisation“. |
| In Salzlösungen und Schmelzen befinden sich frei bewegliche Ionen. Diese sind dafür verantwortlich, dass Salzlösungen bzw. Schmelzen den Strom sehr gut leiten. |