1. Allgemeines zur Salzsäure
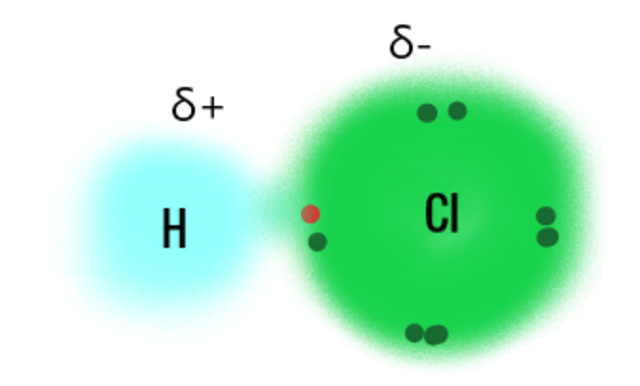
Salzsäure, auch bekannt als Chlorwasserstoffsäure, ist eine wässrige Lösung von Chlorwasserstoff (HCl) und eine starke, anorganische Säure. Sie ist farblos, ätzend und hat einen stechenden Geruch. Salzsäure wird in vielen Bereichen eingesetzt. In der Industrie, bei der Metallverarbeitung, bei der Lebensmittelherstellung sowie für die Reinigung und Desinfektion. HCl ist im menschlichen Körper Bestandteil der Magensäure.
2. Eigenschaften der Salzsäure
- Farbe & Geruch: Farblos bis gelblich mit einem stechenden Geruch.
- Löslichkeit: Sehr gut in Wasser löslich, wodurch sie eine wässrige Lösung von Chlorwasserstoff ist.
- Ätzend: Stark ätzend und kann bei Kontakt schwere Verätzungen verursachen.
- Reaktivität: Eine starke Säure, die mit Basen heftig reagiert und unedle Metalle unter Wasserstoffentwicklung löst.
- Dämpfe: Bei höheren Konzentrationen bilden sich reizende, ätzende Dämpfe. Man nennt das die „rauchende Salzsäure“.
- Konzentration: Industriell in verschiedenen Konzentrationen erhältlich, wobei die höchsten Konzentrationen 37%-40% erreichen können.
- Dichte & Siedepunkt: Eine 36%ige Lösung hat eine Dichte von etwa 1,18–1,19 g/cm³ und einen Siedepunkt von etwa 57 °C
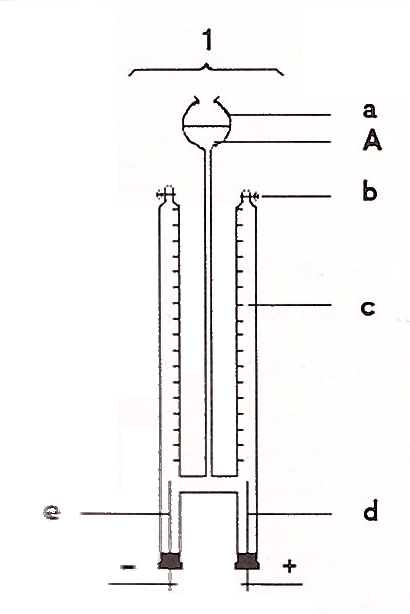
3. Die Elektrolyse von Salzsäure
Experiment mit dem Hofmannschen Zersetzungsapparat
Achtung!
Das Experiment muss im Laborabzug gemacht werden!
Grund: Chlorgas ist giftig und kann zu Verätzungen der Haut, der Atemwege und der Augen führen
Link zum Versuchsvideo:
https://www.youtube.com/watch?v=4ocb_6y7g-w
Quelle: YouTube – Elektrolyse von Salzsäure an Graphit-Elektroden von Frau S. – Creative Commons-Lizenz
Was beobachten wir?
- Am Minuspol, also an der Kathode, steigen farblose Gasbläschen auf.
- Am Pluspol, also an der Anode, steigen gelbgrüne Gasbläschen auf.
- Im linken Rohr sammelt sich etwa gleich viel Gas wie im rechten Rohr.
Wasserstoff
Chlor
gelbgrünes Chlorgas
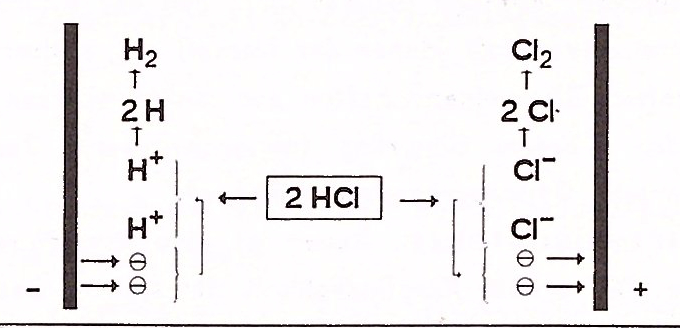
Bei der Elektrolyse von verdünnter Salzsäure (HCl) werden an der Kathode (Minuspol) Wasserstoff (H2) und an der Anode (Pluspol) Chlor (Cl2) erzeugt. Dies geschieht, da elektrische Energie in Form von Gleichstrom verwendet wird, um eine Redoxreaktion zu erzwingen, bei der die Salzsäure in ihre Bestandteile zerlegt wird.
Erläuterung:
- Salzsäure in Lösung:
In wässriger Lösung dissoziiert Salzsäure in Oxonium-Ionen (H₃O⁺) und Chlorid-Ionen (Cl⁻). - Kathode (Minuspol):
Hier werden die positiv geladenen Oxonium-Ionen (H₃O⁺) zu Wasserstoffgas (H₂) reduziert, wobei Elektronen aufgenommen werden:
Reaktionsgleichung
2 H₃O⁺ + 2e⁻ → H₂↑ + 2 H₂O- Anode (Pluspol): Hier werden die negativ geladenen Chlorid-Ionen (Cl⁻) zu Chlorgas (Cl₂) oxidiert, wobei Elektronen abgegeben werden:
Reaktionsgleichung
2 Cl⁻ → Cl₂↑ + 2e⁻- Gesamtreaktion: Die Elektrolyse von verdünnter Salzsäure führt zur Bildung von Wasserstoff und Chlor, wobei elektrische Energie in chemische Energie umgewandelt wird.
Zusammenfassend: Die Elektrolyse von verdünnter Salzsäure ist eine Redoxreaktion, bei der Wasserstoff und Chlor durch die Einwirkung von elektrischem Strom (Gleichstrom) entstehen.
Grafisch
4. Knallgasprobe, Chlor – Nachweis mit Kaliumiodidstärkepapier,
Chlor – Nachweis mit Lackmuspapier
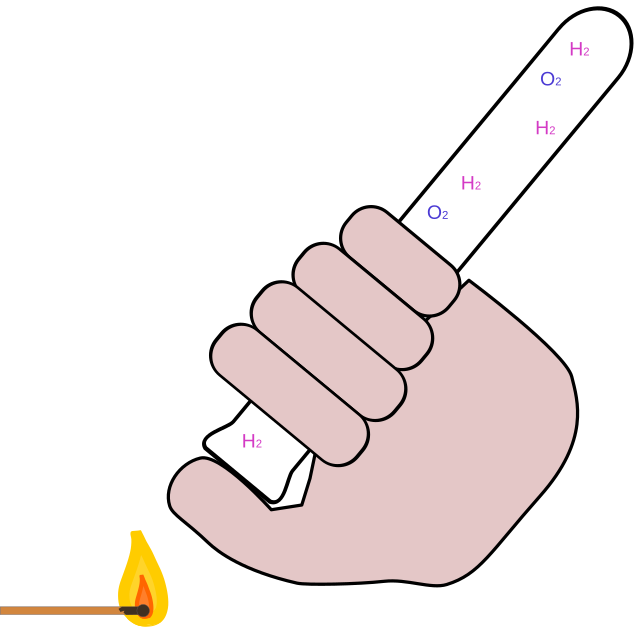
- Wir prüfen das entstandene farblose Gas mit der Knallgasprobe, indem wir das Gas vorher
in einem Reagenzglas auffangen und dann anzünden. Das Reagenzglas muss mit der Öffnung nach unten gehalten werden, da Wasserstoffgas leichter ist als die Gase der Luft und aufsteigt. - Wir testen das gelbgrüne Gas entweder mit:
einem weißen oder blauen, angefeuchtetem Kaliumiodidstärkepapier oder mit feuchtem, blauen Lackmuspapier. - Weißes oder blaues Kaliumiodidstärkepapier wird verwendet, weil es eine einfache und schnelle Möglichkeit bietet, die oxidative Wirkung von Chlor nachzuweisen, indem man die spezifische Farbänderung der Stärke-Iod-Reaktion beobachtet. Weißes Kaliumiodidstärkepapier wird blau. Blaues Kaliumiodidstärkepapier wird entfärbt.
- Feuchtes Lackmuspapier:
Eine weitere gängige Methode zum Nachweis von Chlorgas ist die Verwendung von feuchtem, blauem Lackmuspapier. Dieses blaue Lackmuspapier verfärbt sich zunächst rot und dann weiß.
5. Versuchsergebnis und Auswertung
- Pfeifen oder Knallen: Es handelt sich um eine Knallgasreaktion, bei der Wasserstoff (aus der Salzsäure) und Sauerstoff (von der Luft) zu Wasser reagieren. Dieses Pfeifen oder Knallen ist der Beweis dafür, dass am Minuspol Wasserstoffgas entstanden sein mus.
- Reaktionsgleichung:
- 2 H₂ (g) + O₂ (g) → 2 H₂O (g)
- Zwei Moleküle Wasserstoff reagieren mit einem Molekül Sauerstoff zu zwei Molekülen Wasserdampf.
- Die Knallgasprobe ist also eine einfache, aber effektive Methode, um Wasserstoff nachzuweisen und gleichzeitig die Sicherheit bei Experimenten mit Wasserstoff zu gewährleisten.
- Chlornachweis mit dem weißen Kaliumiodidstärkepapier: Das weiße Kaliumiodidstärkepapier färbt sich blau-violett, da das Chlor das Iodid (die Iodidionen) zu elementarem Iod oxidiert, das wiederum mit der Stärke eine blau-violette Färbung bildet.
- Chlornachweis mit dem blauen Kaliumiodidstärkepapier:
Blaues KI-Stärkepapier wird in Chlorgas entfärbt, da Chlor als stärkeres Oxidationsmittel das Iod aus der Stärke-Iodid-Reaktion verdrängt und die blaue Farbe zerstört. - Feuchtes blaues Lackmuspapier
Reaktion mit Wasser:
Das Chlorgas reagiert mit dem Wasser auf dem feuchten Lackmus-Papier und bildet eine saure Lösung, welche die blaue Farbe des Lackmuspapiers rot färbt.
Bleichende Wirkung:
Anschließend wird der Lackmusfarbstoff durch diese Säure und/oder andere Bleichmittel im Chlor gebleicht, was zur weißen Farbe führt.
Aufgabe 1: Die chemische Formel der Salzsäure lautet
Aufgabe 2: Die Salzsäure „HCl“ ist im menschlichen Körper Bestandteil der ……..
Aufgabe 3: Welches Gas entsteht bei der Elektrolyse verdünnter Salzsäure am Minuspol (Kathode) und was entsteht am Pluspol (Anode)?
Aufgabe 4: Welche Farbe hat das Chlorgas?
Aufgabe 5: Welche Reaktionsgleichung gilt, wenn am Minuspol die positiv geladenen Oxonium-Ionen (H₃O⁺) zu Wasserstoffgas reduziert werden, wobei Elektronen aufgenommen werden:
Aufgabe 6: Wenn wir beim Minuspol das entstandene Gas „Wasserstoff“ in einem Reagenzglas auffangen, wie können wir dieses Gas nachweisen?
Aufgabe 7: Wie können wir das am Pluspol entstandene gelbgrüne Chlor nachweisen?
Aufgabe 8: Welche Eigenschaften treffen auf die Salzsäure zu?
Aufgabe 9: Was beschreibt die folgende Reaktionsgleichung bei der Elektrolyse von HCl (Salzsäure)? 2 Cl⁻ → Cl₂↑ + 2e⁻
Herstellung von Salzsäure
Industrielle Herstellung
Direkte Synthese aus Wasserstoff und Chlor
- Wasserstoffgas (H₂) und Chlorgas (Cl₂) werden in einem speziellen Reaktor unter kontrollierten Bedingungen und hoher Temperatur zusammengeführt.
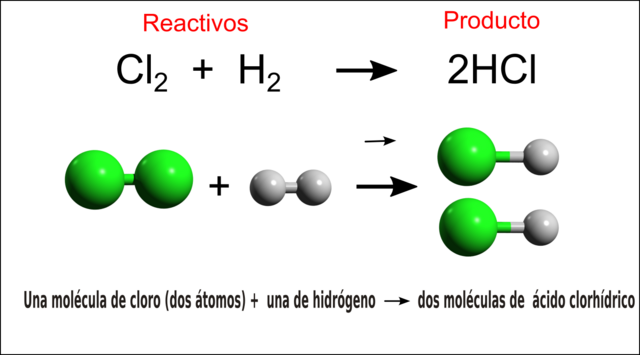
- Die Reaktion ist sehr heftig: H₂ + Cl₂ → 2HCl.
- Das entstandene Chlorwasserstoffgas wird in Wasser absorbiert, um eine wässrige Salzsäure-Lösung zu bilden
Als Nebenprodukt
- Ein großer Teil der industriellen Salzsäure entsteht als Nebenprodukt bei der Herstellung von Kunststoffen wie PVC (Polyvinylchlorid).
- Der dabei freigesetzte Chlorwasserstoff wird anschließend in Wasser eingeleitet.
Herstellung im Labor
Reaktion von Kochsalz und Schwefelsäure
- Konzentrierte Schwefelsäure (H₂SO₄) reagiert mit Kochsalz (Natriumchlorid, NaCl).
- Dabei entsteht Chlorwasserstoffgas (HCl) und Natriumhydrogensulfat (NaHSO₄).
- NaCl + H₂SO₄ → NaHSO₄ + HCl
Absorption in Wasser
Das entstandene Chlorwasserstoffgas wird anschließend in Wasser gelöst, um Salzsäure zu bilden.
Anwendungen im Haus und beim Bau
- Reinigung:
- Salzsäure wird zur Entfernung von Kalk- und Zementrückständen auf Fliesen, in Sanitäranlagen und auf Baustellen eingesetzt.
- Entkalkung:
- Sie kann Kesselstein aus emaillierten Gefäßen und Kupferkesseln entfernen.
- Entrosten:
- Roststellen können von Eisen mit verdünnter Salzsäure beseitigt werden.
- pH-Wert-Regulierung:
- Im Schwimmbad wird Salzsäure zur Einstellung des Wasser-pH-Werts verwendet, um die Wasserqualität zu erhalten.
Anwendungen in der Lebensmittelindustrie
- E 507:
- Unter der Bezeichnung E 507 ist Salzsäure ein zugelassener Lebensmittelzusatzstoff.
- Produkte:
- Sie findet sich in der Zusammensetzung von Hüttenkäse, homogenisiertem Käse, Gewürzmischungen und Sirup.
- Säureeinstellung:
- Sie dient der Regulierung des Säuregehalts in der Lebensmittelherstellung.
Biologische Bedeutung
- Magensaft: Salzsäure ist ein natürlicher Bestandteil des menschlichen Magensaftes.
- Verdauung: Sie denaturiert Proteine und schafft das saure Milieu, das das Verdauungsenzym Pepsin benötigt, um wirksam zu sein.
- Keimabtötung: Sie hilft, Mikroorganismen im Magen abzutöten.
Hinweise
Gefährlich
Salzsäure ist eine aggressive Säure, die bei unsachgemäßer Anwendung gesundheitsschädlich sein kann und immer mit äußerster Vorsicht und Schutzkleidung gehandhabt werden muss.
Umwelt
Die Verwendung von Salzsäure zur Unkrautbekämpfung ist nicht zu empfehlen, da sie umweltschädlich ist und den Boden nachhaltig schädigt.