1. Eigenschaften von Schwefelsäure
- Starke Säure, ätzend und wasseranziehend (hygroskopisch).
- Exotherm – beim Verdünnen wird viel Wärme freigesetzt.
- Korrosiv – greift Metalle und Haut an.
2. Verwendung
- Düngemittelproduktion (z. B. Phosphate)
- in Autobatterien (Akkumulatorsäure).
- Herstellung von Chemikalien (z. B. Waschmittel/Tenside, Farbstoffe)
- Ölraffinerien, Metallverarbeitung, Laborwaagen-Reinigung
- Aufschluss von Erzen.
- zum Ätzen von Halbleitern.
- als Katalysator oder Reaktionshilfsmittel für organische Synthesen
3. Bildung / Herstellung
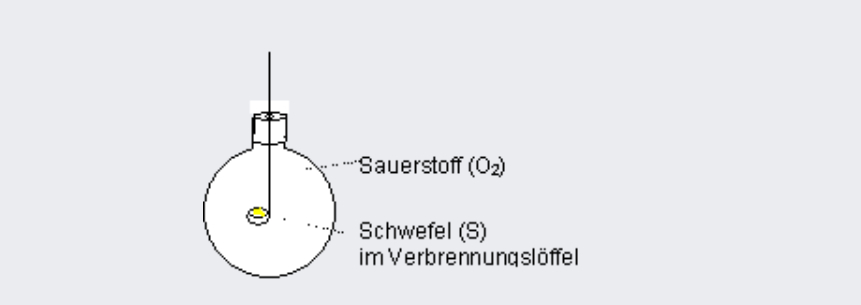
Versuch A – Schwefel in Sauerstoff verbrennen:
- Schwefel verbrennen:
S + O₂ → SO₂ - Oxidation durch Vanadiumpentoxid-Katalysator:
2 SO₂ + O₂ → 2 SO₃ - Absorption von SO₃ in H₂SO₄ → Oleum (H₂S₂O₇), dann Zugabe von Wasser:
- SO₃ + H₂SO₄ → H₂S₂O₇
- H₂S₂O₇ + H₂O → 2 H₂SO₄
4. Experimente
Experiment B – Erhitzung beim Verdünnen
Kleines Gefäß mit konzentrierter H₂SO₄ und Wasser (unter Belüftung und mit Handschuhen). Verdünnung ist hoch exotherm – es entsteht heißes Wasser.
Experiment C – Reaktion mit Zucker
Zucker in Reagenzglas + tropfenweise H₂SO₄ → Dehydrierung, schwarzer Kohlenstoff verbleibt. Nur im Labor mit Schutzmaßnahmen!
5. Reaktionsgleichungen – vereinfacht dargestellt
SO₂ + O₂ → SO₃
SO₃ + H₂O → H₂SO₄
6. Wie reagiert verdünnte Schwefelsäure mit Metallen?
Reaktion verdünnter Schwefelsäure mit Metallen
Verdünnte Schwefelsäure reagiert mit vielen Metallen unter Bildung von Wasserstoffgas und einem Metallsulfat. Die Reaktion ist eine Redoxreaktion. Das Metall gibt Elektronen ab und wird zu einem Metall-Kation, während die Wasserstoffionen der Säure Elektronen aufnehmen und zu Wasserstoffgas reduziert werden.
Allgemeine Reaktionsgleichung:
Metall + Schwefelsäure -> Metallsulfat + Wasserstoff
Beispiele für Reaktionen:
- Zink: Zink reagiert mit verdünnter Schwefelsäure unter Bildung von Zinksulfat und Wasserstoff.
- Zn + H₂SO₄ -> ZnSO₄ + H₂
- Eisen: Eisen reagiert ähnlich wie Zink und bildet Eisensulfat und Wasserstoff,
- Fe + H₂SO₄ -> FeSO₄ + H₂
- Magnesium: Magnesium ist reaktiver als Eisen und reagiert ebenfalls mit verdünnter Schwefelsäure unter Wasserstoffentwicklung.
- Mg + H₂SO₄ -> MgSO₄ + H₂
- Aluminium: Auch Aluminium reagiert mit verdünnter Schwefelsäure unter Bildung von Aluminiumsulfat und Wasserstoff, laut BBC.
- 2Al + 3H₂SO₄ -> Al₂(SO₄)₃ + 3H₂
Einfluss der Reaktivität der Metalle:
- Je reaktiver das Metall, desto schneller verläuft die Reaktion mit verdünnter Schwefelsäure.
- Unedle Metalle wie Zink, Eisen, Magnesium und Aluminium reagieren mit verdünnter Schwefelsäure.
- Edle Metalle wie Gold und Platin reagieren nicht mit verdünnter Schwefelsäure.
Hinweis: Konzentrierte Schwefelsäure verhält sich anders und kann auch edlere Metalle unter bestimmten Bedingungen angreifen und oxidieren.